Las reacciones químicas además de generar sustancias nuevas (productos) a partir de los reactivos, también interactúan con distintos tipos de energía; entre ellos el calor. Las reacciones químicas que generan calor al efectuarse, se llaman reacciones exotérmicas; las que absorben calor se llaman endotérmicas.
El concepto que está involucrado aquí es: entalpía. La entalpía (∆H) es la cantidad de calor medido a presión constante, que una reacción química absorbe o desprende al efectuarse. El cambio en la entalpía de reacción es positivo cuando la reacción es endotérmica y es negativo si la reacción es exotérmica.
Las reacciones exotérmicas más comunes son las reacciones de combustión, que se presentan al quemar mezclas como la gasolina, el gas LP, el diésel o la turbosina; en este tipo de reacciones los hidrocarburos reaccionan químicamente con el oxígeno del aire y generan dióxido de carbono y vapor de agua, produciendo por supuesto calor y luz. Y sabemos que estas reacciones tienen muchas aplicaciones: el movimiento de los automóviles, los vuelos en aviones de pasajeros, el transporte de mercancías mediante camiones, la cocción de alimentos, la generación de vapor en las industrias, la generación de electricidad en las termoeléctricas, etcétera.
Las reacciones exotérmicas son muy útiles para calentar alimentos, de hecho, su primera aplicación fue en el ámbito militar para que los soldados pudieran disfrutar de comida caliente y nutritiva en el campo de batalla; pero también se emplean en ámbitos civiles como el senderismo, montañismo, etcétera; en donde es muy importante disponer de alimentos nutritivos y calientes, sobre todo en ambientes fríos, también es importante poder transportar comida sin mucho esfuerzo; es decir que su peso no sea elevado, ni que debas transportar también gas y hornillos para cocinarla.
Una de estas reacciones químicas es conocida como Crosse & Blackwell, su ecuación se muestra a continuación:
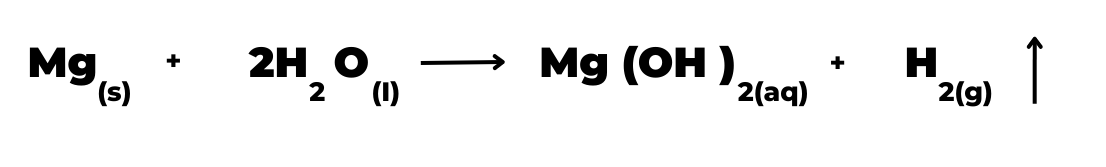
La reacción anterior a 25°C y 1 atm de presión libera 84 061 calorías de energía térmica por cada 24g de magnesio, energía más que suficiente para calentar 1 litro de agua desde 25°C hasta 100°C, en consecuencia, se produce la energía suficiente para calentar alimentos. Sin embargo, la reacción ocurre muy lentamente por lo que se requiere de materiales que la aceleren, con este fin los reactivos anteriores se mezclan con hierro y cloruro de sodio, de esta manera la reacción se efectúa en pocos minutos.
Los alimentos autocalentables deben estar precocinados, pero incluyen una gran variedad de posibilidades como pueden ser: Tortellini de queso en salsa de tomate, pollo con arroz, pavo con frijoles y chile, etcétera; todos estos alimentos se almacenan al vacío (lo que permite su conservación durante mucho tiempo, inclusive 25 años) en bolsas hechas de aluminio, el cual facilita la transferencia de calor. Su peso es de entre 200 y 250g, por lo cual son muy prácticos para transportar. Para calentarlos se utiliza una bolsa térmica de mayor tamaño que evita la pérdida de calor hacia el ambiente, esta bolsa es reutilizable y puede estar fabricada con tereftalato de polietileno (PET), espuma de poliestireno, polietileno, poliuretano o polipropileno, tiene una cremallera que permite abrirla, introducir el sobre con alimentos y cerrarla.
 Alimentos autocalentables ,Comida instantánea
Alimentos autocalentables ,Comida instantáneaCada bolsa de alimentos incluye una pastilla (sobre) que contiene los reactivos como el magnesio, hierro y cloruro de sodio (sal de mesa), este sobre se coloca en el fondo de la bolsa térmica, encima se coloca el sobre con alimentos y se agrega un poco de agua (entre 80 y 120mL) para iniciar la reacción, la bolsa térmica se cierra y el calor liberado por la reacción química es capaz de evaporar el agua y de esta manera tendrás alimentos sabrosos y calientes sin utilizar fuego; tampoco necesitarás de recipientes adicionales ya que puedes comer directamente desde la bolsa. La bolsa térmica puede reutilizarse hasta en 10 ocasiones, por lo que también se reduce la generación de basura, además de que no se emite al ambiente dióxido de carbono principal causante del calentamiento global, al evitar usar la combustión para calentar tus alimentos.
Además de los alimentos precocinados, también pueden usarse alimentos liofilizados. Básicamente se trata de alimentos deshidratados al vacío con un tiempo de conservación bastante prolongado. Aquí también están involucrados procesos químicos que involucran métodos de separación de mezclas:
Al eliminar el agua y el aire, se evita la proliferación de microorganismos que pueden echar a perder los alimentos.
No todas las reacciones exotérmicas son deseables, por ejemplo; en la fabricación de piensos o alimentos secos para animales se utiliza una dieta a base de distintas materias primas y aditivos; pero el proceso de fabricación puede provocar transformaciones físicas y químicas, las empresas que fabrican las premezclas para la elaboración de estos alimentos requieren incrementar la temperatura para esterilizar la harina o para lograr la granulación, esto puede provocar la inactivación o descomposición de algunos nutrientes por lo que es necesario agregarlos posteriormente; estos nutrientes se consideran microcorrectores si se agregan en porcentajes menores al 0.5% y son macrocorrectores si se agregan en porcentajes mayores al 1%.
Dentro de los macrocorrectores se encuentran los fosfatos, cuando estos se adicionan a las premezclas pueden reaccionar químicamente con carbonatos, óxidos, bicarbonatos y sales, algunas de ellas son reacciones exotérmicas que pueden desactivar principalmente a las vitaminas y enzimas, que son compuestos sensibles a la temperatura; por lo tanto, es necesario aumentar la cantidad de vitaminas en los piensos.
Una manera de evitar reacciones exotérmicas indeseables es no usar fosfatos ácidos, en su lugar utilizar fosfato monocálcico o dicálcico, por lo que, para garantizar la calidad del alimento preparado, debe realizarse una selección cuidadosa tanto de los micro como de los macrocomponentes.
Así que las reacciones exotérmicas pueden resultar muy útiles, pero también indeseables e incluso peligrosas. Pero esto es otro caso más, del maravilloso universo de la química.
Estas Historias En Química
Xochicalco 187 Col. Narvarte,
Ciudad de México, C.P. 03020
Llámanos: 800 68 500 50
Email: info@conamat.com
¡Queremos escucharte!
Escríbenos un comentario