Los enlaces químicos suelen definirse con mucha frecuencia, como fuerzas de atracción que mantienen unidos a dos o más átomos para formar unidades químicas mayores como: moléculas, iones y cristales. En realidad, su definición es un poco más compleja.
Los enlaces químicos se relacionan con los electrones, los cuales se mueven a velocidades extremadamente altas, en el orden de la tercera parte de la velocidad de la luz (100 000km/s aproximadamente). De acuerdo con el principio de incertidumbre de Heisenberg: es imposible determinar con precisión y simultáneamente, la velocidad y la posición de un electrón; en lugar de eso, su movimiento se estima mediante “nubes” de probabilidad llamadas orbitales, los cuales se deducen a partir de la ecuación de Schröndinger y usando la interpretación probabilística de la función de onda que fue propuesta por Max Born; es decir, el movimiento de un electrón se describe mediante una función de onda por la cual se manifiesta la naturaleza dual de materia y energía en esta partícula subatómica.
De acuerdo con lo anterior, un enlace químico se forma cuando la onda de un electrón de valencia de un átomo se combina con la onda de otro electrón de valencia de otro átomo, propiciando una especie de interferencia constructiva; como cuando dos ondas de sonido se sobreponen y se refuerzan entre sí aumentando su intensidad.
Los enlaces químicos son los responsables de que los materiales exhiban determinadas propiedades. En el caso de los metales: sus átomos pierden electrones de valencia con mucha facilidad (son muy electropositivos), pero éstos permanecen “libres” en el cuerpo metálico, sea éste un alambre, una placa o un bloque; esto provoca que puedan moverse libremente bajo la aplicación de una diferencia de potencial eléctrico otorgándoles su capacidad para conducir la electricidad; también pueden moverse siguiendo un gradiente de temperatura (se mueven desde la zona con mayor temperatura hacia la zona con menor temperatura); esta es la razón de por qué los metales son buenos conductores del calor.
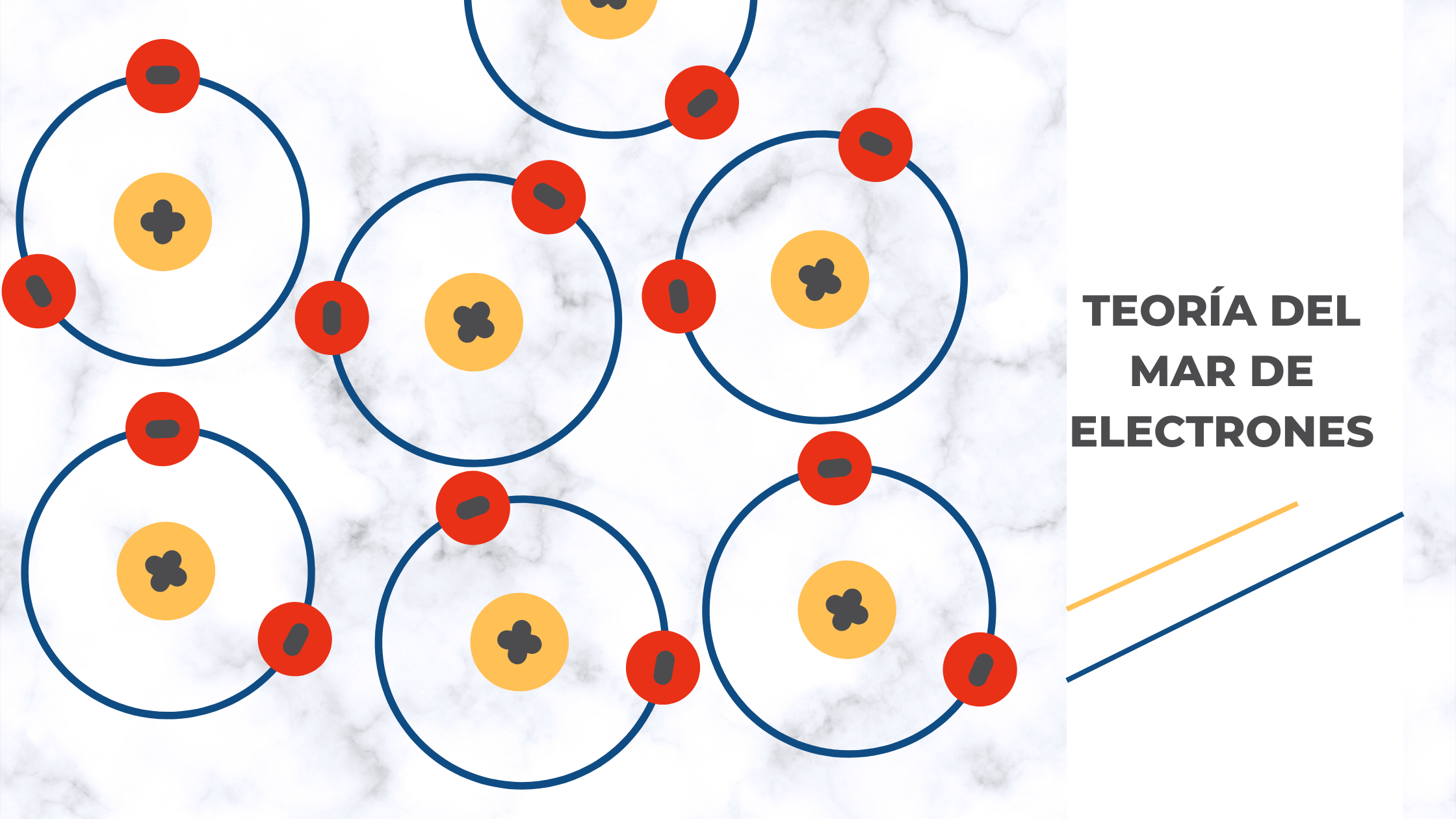 Teoría del mar de electrones.
Teoría del mar de electrones.¿Y qué pasa con los semimetales o metaloides? ¿Por qué son capaces de conducir la electricidad, pero no son tan buenos conductores térmicos? Es frecuente describir a los semimetales como materiales que presentan propiedades metálicas y no metálicas, sus electrones de valencia tienen un comportamiento similar a los metálicos, pero no son exactamente iguales. En el caso de los metales, los electrones se mueven a través una “banda de energía” denominada banda de conducción, formada por la combinación de orbitales p originalmente vacíos; mientras que en el caso de los semimetales los electrones se ubican en una “banda de valencia” que no permite el libre movimiento de los electrones (no conduce la electricidad); pero la banda de conducción se ubica muy cerca de la de valencia, por lo que al suministrar poca energía a los electrones, estos pueden saltar a la banda de conducción; este es básicamente el principio de funcionamiento de las celdas solares fabricadas con silicio cristalino, la energía necesaria para permitir la conducción eléctrica la proporciona la luz. Sin embargo, la conducción térmica no es tan sencilla, dado que las radiaciones infrarrojas responsables de la conducción térmica radiante no suelen proporcionar la energía suficiente.
Los enlaces químicos que se presentan entre elementos no metálicos, como el H y el O en la molécula de agua, son de naturaleza diferente (presenta enlaces covalentes polares); la electronegatividad de estos átomos es similar entre sí y son más electronegativos que los metales; es decir, no pierden electrones fácilmente. El oxígeno es más electronegativo que el hidrógeno, esto provoca que en la molécula de agua el oxígeno forme un polo negativo, mientras que los dos átomos de hidrógeno forman el polo positivo; esto favorece la disolución de sustancias, como el caso del cloruro de sodio, una sustancia que está formada por un ion positivo (Na+) y un ion negativo (Cl-). Cuando un cristal de cloruro de sodio se sumerge en agua, el oxígeno atrae al Na+ separándolo del Cl- el cual es atraído por los átomos de hidrógeno de otras moléculas de agua; esto favorece su separación y produce su disolución. Esta es la razón de por qué el agua es capaz de disolver a una gran variedad de sustancias, sobre todo sustancias iónicas y covalentes polares; aunque no es capaz de disolver sustancias covalentes no polares como el aceite.
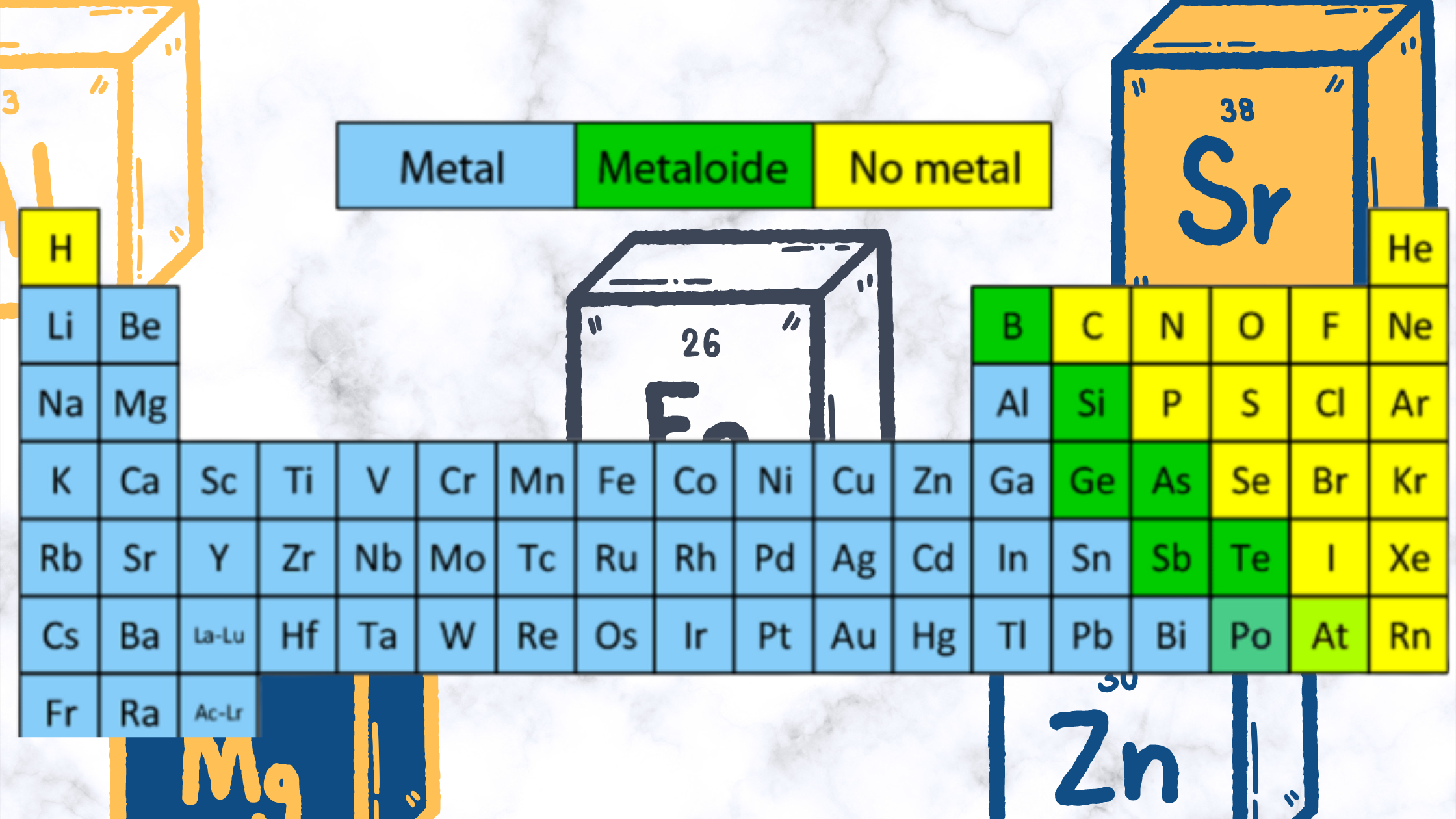 Tabla periódica.
Tabla periódica.Las sustancias formadas por iones positivos (cationes) y negativos (aniones) presentan un enlace iónico caracterizado por la fuerza de atracción debida a la interacción de cargas eléctricas con signos contrarios, estas sustancias suelen ser cristalinas y con altos puntos de fusión y de ebullición.
Hay muchas propiedades físicas y químicas más, que pueden ser explicadas en función del tipo de enlace que presentan los materiales como: la elasticidad, transparencia, dureza, maleabilidad, densidad, tensión superficial; esto es el fundamento de la selección de materiales que debe hacerse previamente, para construir máquinas, edificios, componentes electrónicos, lentes, automóviles, aviones, prendas de vestir, cascos, etcétera.
Estas Historias En Química
Xochicalco 187 Col. Narvarte,
Ciudad de México, C.P. 03020
Llámanos: 800 68 500 50
Email: info@conamat.com
¡Queremos escucharte!
Escríbenos un comentario